La rétine jouerait un rôle clé dans le dépistage de la pathologie. Des scientifiques italiens le confirment et ont développé une méthode optique de diagnostic innovante.
Un jour, il oublie ses clés, le lendemain, le prénom de ses élèves. Des trous de mémoire anodins mais qui finissent par se multiplier jusqu’à ce que Pascal, la soixantaine, professeur de biologie, s’inquiète de la situation. «Tu es fatigué Pascal, tu travailles trop»; «moi aussi, j’ai quelques pertes de mémoire, ça arrive à tout le monde», tente de le rassurer son entourage. Mais ces petits oublis du quotidien continuent. A 63 ans, Pascal décide de passer des examens médicaux. La première année, son bilan cognitif est à surveiller mais il n’y a rien d’inquiétant. L’année suivante, les résultats sont moins bons et les médecins décident d’investiguer. Le diagnostic tombe. Pascal souffre de la maladie d’Alzheimer.
C’est d’abord la sidération, puis les larmes. «Ça a été un moment très difficile pour lui comme pour moi, raconte Valérie, une des sœurs de Pascal. Le mot fait très peur et on sait qu’il ne guérira pas de cette maladie.» De fait, cette maladie aux mécanismes complexes et forme de démence la plus courante –60% à 70% des cas en 2023, d’après l’Organisation mondiale de la santé (OMS)– est actuellement incurable.
Du mécanisme biochimique aux troubles cognitifs
Les formes de démence augmentent significativement depuis plusieurs années. En 2050, le nombre de malades dans le monde pourrait s’élever à 152,8 millions, soit une augmentation d’environ 166% depuis 2019. En cause, essentiellement, le vieillissement de la population. «L’âge est le principal facteur», confirme François Meyer, neurologue au CHU de Liège et coordinateur du Centre de la mémoire.
Si l’âge est le principal facteur, il n’est pas la seule cause: des facteurs environnementaux, socioculturels et génétiques entrent également en jeu. Dans de plus rares cas, la mutation ou le polymorphisme d’un gène peut se transmettre de génération en génération.
Le développement de cette pathologie est difficile à appréhender, car une foule de mécanismes biochimiques s’enclenchent en même temps. On parle de «cascade amyloïde». Pour des raisons encore ignorées des scientifiques, des protéines évoluent de manière anormale dans le système cérébral. Le cerveau peine à les éliminer, elles finissent par s’accumuler et se compacter pour former des plaques amyloïdes au niveau du tissu cérébral. «Ces plaques sont toxiques et engendrent des dysfonctionnements en cascade tels que la mort de neurones ou une inflammation cérébrale», décrit le Dr. Meyer. Ces altérations déclenchent alors des troubles cognitifs comme des pertes de mémoire, des difficultés d’orientation dans l’espace ou des troubles du langage. Les femmes sont les plus touchées par ces symptômes: deux malades d’Alzheimer sur trois sont de sexe féminin, selon la Fondation recherche Alzheimer.
Au premier stade, dit «stade modéré», ces symptômes restent bénins et n’ont que peu d’effet sur la vie quotidienne. Ils sont généralement détectés entre 60 et 65 ans. Puis la situation évolue jusqu’au stade de la démence. La personne perd en autonomie jusqu’à devenir de plus en plus dépendante et incapable de reconnaître son environnement. «A cause de ses pertes de mémoire, ma mère devenait dangereuse pour elle-même. Continuer à la laisser vivre dans sa maison était extrêmement compliqué et source d’angoisse pour nous», confie Catherine Soubiran, fille de Jeanne-Marie, âgée de 90 ans.
La complexité du cerveau empêche encore les scientifiques d’appréhender en détail l’engrenage de la maladie. Cependant, les études se multiplient. Du diagnostic précoce au développement de nouveaux traitements, de nouvelles pistes et découvertes éclosent.
La technique analyse la formation des protéines anormales en fonction de la manière dont elles réfléchissent ou absorbent la lumière.
Alzheimer, une empreinte sur la rétine
A ce jour, le diagnostic est souvent posé lorsque les fonctions cérébrales sont déjà atteintes, et l’apparition de troubles cognitifs irréversibles. Les méthodes actuelles de dépistage sont la ponction lombaire ou l’IRM, des techniques invasives et/ou coûteuses.
En mars 2025, la scientifique Zita Salajková, postdoctorante au centre de nanosciences et neurosciences de la vie à l’Institut italien de la technologie, et ses collègues ont publié les résultats d’un nouveau dispositif de dépistage de la maladie par voie rétinienne. Ils démontrent que les agrégats des protéines anormales sont visibles sur la rétine, la seule partie du système nerveux central observable de manière non invasive. Il s’agit essentiellement de la protéine Tau et de fragments de peptide bêta-amyloïde (Aβ). Ces dernières vont prendre une forme de fibres puis l’une va s’accumuler à l’intérieur du neurone tandis que l’autre va former les fameuses plaques amyloïdes. C’est par le biais de cette transformation que les scientifiques vont pouvoir mieux appréhender la maladie d’Alzheimer.
Pour la première visualisation des plaques amyloïdes à travers la rétine, les scientifiques ont utilisé de la curcumine, un fluorochrome naturel, administré par voie orale. Ils ont ensuite eu recours à un scanner rétinien permettant de confirmer la possibilité d’observation de manière non invasive des plaques Aβ mais aussi de détecter l’augmentation de la quantité de protéine.
Par après, l’équipe italienne a utilisé une imagerie hyperspectrale (HSI), une technique capable d’analyser la formation des protéines en fonction de la manière dont celles-ci réfléchissent ou absorbent la lumière. «La HSI est particulièrement efficace pour capturer la signature spectrale car elle enregistre avec précision l’intensité de réflexion sur une large gamme de longueurs d’onde», précise Zita Salajková. Cette signature spectrale est un point important dans l’étude, «elle résulte de l’interaction entre la lumière et les agrégats de protéines qui dépend de la longueur d’onde», ajoute la postdoctorante. Autrement dit, elle constitue une empreinte permettant de détecter les protéines Tau ou Aβ impliquées dans la maladie d’Alzheimer.
Ce nouveau type de dépistage favorisera aussi le développement de nouveaux médicaments.
Faire la lumière
Le développement des protéines fibrillées va commencer à former de petits amas. Dans un premier temps, ceux-ci sont plus petits que la longueur d’onde de la lumière et diffuseront une lumière bleue –ce qu’on appelle la diffusion Rayleigh. En devant plus gros, ils réfléchiront la lumière différemment –c’est la diffusion Mie.
La diffusion Rayleigh constitue un point clé pour déterminer l’apparition et le développement des protéines anormales avant l’apparition des troubles cognitifs: «Elle détecte les premiers stades de l’agrégation des protéines, contribue à la signature spectrale, estime la taille des agrégats et permet de comprendre les mécanismes de fibrillation protéique», détaille Zita Salajková.
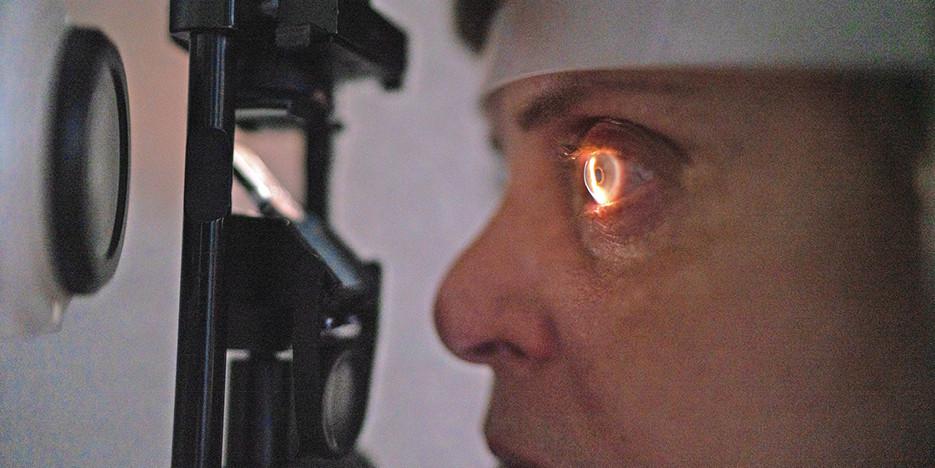
Malgré la pertinence de la technique HSI pour observer les premières protéines anormales, les scientifiques n’obtiennent pas encore toutes les informations nécessaires. Restait à déterminer comment les protéines diffusent la lumière en fonction de leur forme, leur taille ou leur structure. «Notre étude répond à cette lacune en introduisant une nouvelle technique: la spectroscopie de diffusion latérale, qui mesure directement les propriétés de diffusion des fibrilles de protéines», s’enthousiasme la chercheuse. La manière dont la lumière se disperse sur les protéines peut alors être analysée plus précisément. Ainsi, les scientifiques ont pu observer que plus les protéines Tau s’accumulent et grossissent avec le temps, plus la lumière est dispersée. Conséquence: les changements de la structure des protéines sont visibles.
Ces résultats encourageants favorisent la transformation de la technologie en un outil de dépistage précoce de la maladie d’Alzheimer qui permettra de poser un diagnostic avant même l’apparition des troubles cognitifs et favorisera le développement de nouveaux médicaments. Un point non négligeable puisque, aujourd’hui, les médicaments utilisés ont pour unique fonction de traiter les troubles cognitifs en boostant le cerveau. «Mais l’effet est modéré et limité dans le temps, la maladie continue d’évoluer», insiste François Meyer.
En novembre 2024, l’Agence européenne des médicaments (EMA) a approuvé la commercialisation du nouveau traitement Leqembi®, une immunothérapie anti-Alzheimer. Pour en bénéficier, le patient doit être au stade précoce et ne pas présenter de risque génétique. Cette immunothérapie cible les protéines des plaques amyloïdes dans le cerveau. Après plus d’un an de traitement, les symptômes cognitifs sont réduits de 27%. Ce traitement reste toutefois contraignant, car «il est administré par voie intraveineuse toutes les deux semaines pendant plus d’un an et le patient doit régulièrement passer des IRM pour surveiller les risques de complications», note François Meyer. Pour autant, le neurologue le décrit comme «une piste d’espoir».
Ces avancées scientifiques ne sont pas l’unique moyen de freiner les symptômes. Une bonne hygiène de vie et des activités socioculturelles permettent au cerveau d’être plus en forme et plus à même de stabiliser la maladie sur le long terme. Dès l’enfance, l’humain développe une ressource cognitive. Celle-ci se construit par l’apprentissage, la découverte, les échanges sociaux, tout ce qui permet de stimuler le système nerveux. Plus cette ressource cognitive est développée, plus le cerveau saura faire face à la maladie.
C’est le cas de Pascal. Il continue à citer le nom des plantes en latin et à poster des descriptions de végétaux, accompagnées de photos prises durant ses promenades, «mais ce sont sur des petites choses du quotidien qu’il peine. Il s’est déjà perdu sur un chemin qu’il connaît pourtant par cœur», se désole sa sœur.
Des proches en quête de solutions
Les situations du quotidien sont parfois difficiles à vivre pour l’entourage des patients atteint d’Alzheimer, d’autant qu’en Belgique, 70% des malades vivent à domicile. Les proches peinent à assurer le soutien nécessaire et sont souvent oubliés. «C’est une maladie qui les dépasse, constate Marie Bourcy, directrice de l’association Alzheimer Belgique. L’an dernier, nous avons reçu 25% d’appels en plus, l’entourage cherche des solutions.»
L’association met en place différents ateliers tels que l’art-thérapie adaptée aux difficultés cognitives de la personne ou encore les «café-souvenirs» pour que les malades puissent rester actifs. Des formations et des psychoéducations sont en outre organisées pour expliquer la maladie, répondre aux questions des aidants proches et les aider à maintenir le lien. «La psychoéducation peut leur permettre de choisir leur combat, de savoir où ils investissent leur énergie. Les aidants sont souvent très seuls, ils ont besoin d’être entourés par des professionnels», conclut Clémence Lefèvre, neuropsychologue et chargée de projet à l’association Alzheimer Belgique.
Sarah Boulvard

















